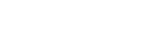歌禮製藥 (1672 HK)
ASLETIS PHARMA INC.
一體化抗病毒平臺,目前僅一項産品商業化 – 歌禮製藥專注於就抗 HCV、HIV 及 HBV 同類最佳創新藥物的開發和商業化,涵蓋從新藥探索和開發直到生產和商業化的完 整價值鏈。目前公司有 5 項抗病毒藥物發現和開發計劃,包括兩個處於或臨近商業 化階段的丙肝在研藥物和一個已完成 IIa 期臨床試驗的 HIV 在研藥物,此外,公司 也有一個已完成 I 期及 I 期擴展臨床試驗的肝癌在研藥物。目前,公司核心産品包 括戈諾衛®、拉維達韋、ASC09 及 ASC06。國家食品藥品監管總局於 2018 年 6 月 8 日授出有關達諾瑞韋的新藥申請批准且我們已於中國開始將戈諾衛®(達諾瑞韋) 進行商業化。戈諾衛®是中國首種由國內公司開發的商業化階段的 HCV 治療藥物。
丙肝新藥拉維達韋臨近商業化 – 該公司預計於 2018 年第三季度提交拉維達韋的新 藥申請。公司認為拉維達韋是一種同類最佳的,針對丙肝 NS5A 靶點的泛基因型 DAA。拉維達韋與戈諾衛® 及利巴韋林共同服用時構成全口服、不含幹擾素的 HCV 治療方案(「RDV/DNV 治療方案」)。該治療方案的優勢包括:具有 99%的治癒率 (SVR12)、更短的療程(12 周)、優異的安全性表現以及對基綫 NS5A 耐藥突變患者 具有 100%的治癒率(SVR12),前景良好。目前公司的戈諾衛® 及拉維達韋被國家食 品藥品監管總局指定爲國家一類新藥。一類新藥是指從未在任何國家上市銷售的新 藥,並有資格獲得國家食品藥品監管總局的優先審批或快捷批核。
市場前景較大 – 目前公司處於商業化和臨近商業化的兩種新藥均針對丙肝。丙型肝 炎為一種由 HCV 引起的廣泛傳染性肝臟疾病,目前並無疫苗。2017 年,中國丙型 肝炎的患病率為 1.82%,約有 2,520 萬 HCV 感染者。由於對疾病缺少認識及欠缺突 破的療法,以及大多數患者經歷的症狀相對較少,HCV 的診斷率過往一直較低。HCV 新感染者及再感染者於 2017 年分別約為 350,000 名及 2,000 名。由於缺少抗 HCV 的 突破性治療,於 2017 年僅約 74,000 名患者得以治療,治療率僅為 0.3%。此外,根 據 F&S 報告,現有主要的聚乙二醇幹擾素和利巴韋林聯合療法預計到 2023 年將完 全被 DAA 療法所取代,DAA 療法既公司新藥所適用的療法。
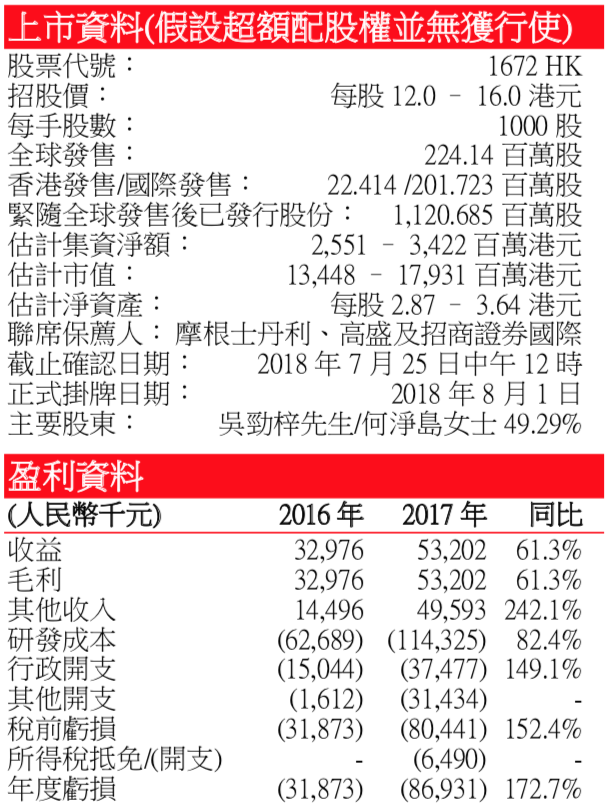
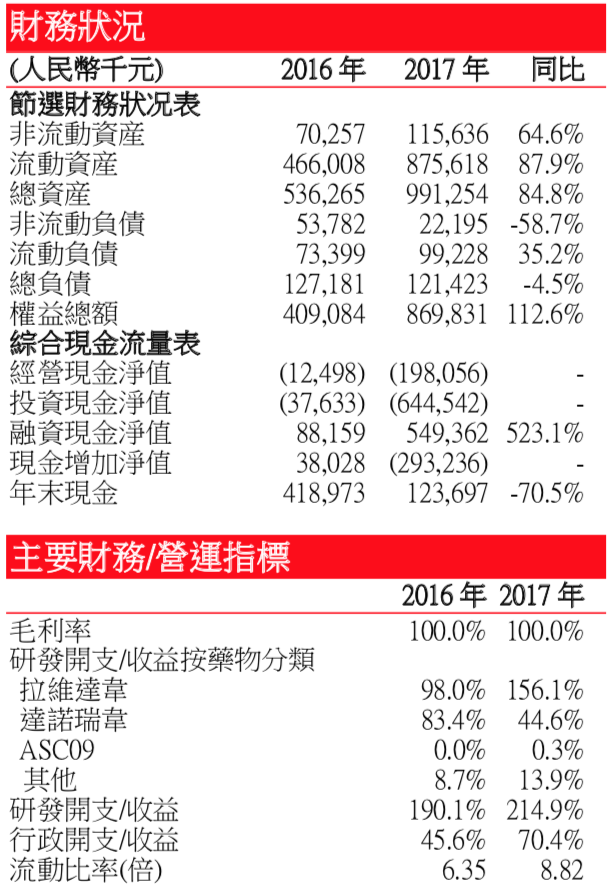
尚無産品銷售收益 – 公司於 2018 年 6 月 27 日開始銷售戈諾衛®。因此於往績記錄 期,並無產生任何產品銷售收益,目前的收益爲公司於期內獲得確認的有關其許可 安排的分期及前期付款。於 2016 年、2017 年及截至 2018 年 3 月底止三個月,公 司分別確認收益人民幣 3,300 萬元、人民幣 5,320 萬元及人民幣 5,110 萬元,均來自 羅氏就其有關戈諾衛® 許可安排向其支付的里程碑及預付款項。目前公司的主要産 品和在研藥物分別與不同許可方簽訂協議,如公司就達諾瑞韋與羅氏(ROG SW)簽 訂獨家許可協議;就拉維達韋與 Presidio 簽訂獨家許可協議;就 ASC09 HIV 蛋白酶 抑制劑與强生(JNJ US)簽訂獨家許可等。目前 2016 年,2017 年和 2018 年前三月, 公司分別虧損人民幣 3187.3 萬元,8693.1 萬元和 85.8 萬元。但公司現金流較爲充裕, 同期流動比率分別爲 6.4 倍、8.8 倍和 11.4 倍。
公司未來的發展策略
1)進一步開發核心産品以及開發其他藥物計劃及尋求引進許可及收購機會。
2)利 用資源和資金持續進行商業化工作及開發銷售網絡。
3)開發及維持與分銷商、醫院、 供應商及其他業務夥伴的更多業務關係。
4)吸引、招募、留任及激勵經驗豐富的合 資格員工。
主要風險因素
– 目前公司僅戈諾衛®(達諾瑞韋)獲得新藥批准,成功商業化,若公司其他産品 不能獲得新藥批准,商業化失敗,將對公司造成較大損失。 – – 公司商業化産品戈諾衛®(達諾瑞韋)於近日獲得新藥批准,該藥是否能够受到 市場認可尚未可知。若銷售情况不佳,將對公司産生不良影響。
– 目前大型製藥及生物技術公司、學術機構、政府機構及其他公營及私營研究機 構已商業化或正在進行商業化或追求開發針對肝炎及其他傳染病的抗病毒藥 物,公司産品或會面對激烈的市場競爭。
– 公司仍有較多在研藥物,需要較多資源進行研發,若研發資金短缺,將對公司 産生較大不良影響。
– 公司爲藥品研發生産及銷售企業,如若出現藥品安全問題,將對公司産生不可 估量的重大損失。

權益披露
分析員 嚴涵 (CE: BFN097) 及其關連人士沒有持有報告內所推介的證券的任何及相關權益。
披露:此研究報告是由南華資料研究有限公司的研究部團隊成員(“分析員”)負責編寫及審核。分析員特此聲明,本研究報告中所表達的意見,準確地反映了分析員對報告內所述的公(“該公司”)及其證券的個人意見。根據香港證監會持牌人操守準則所適用的範圍及相關定義,分析員確認本人及其有聯繫者均沒有(1)在研究報告發出前30日內曾交易報告內所述的股票;(2)在研究報告發出後3個營業日內交易報告內所述的股票;(3)擔任報告內該公司的高級人員;(4)持有該公司的財務權益。分析員亦聲明過往、現在或將來沒有、也不會因本報告所表達的具體建議或意見而得到或同意得到直接或間接的報酬、補償及其他利益。
南華金融控股有限公司包括其子公司或其關聯公司(“南華金融”)可能持有該公司的財務權益,而本報告所評論的是涉及該公司的證劵,且該等權益的合計總額可能相等于或高於該公司的市場資本值的1%或該公司就新上市已發行股本的1%。一位或多位南華金融的董事、行政人員及/或雇員可能是該公司的董事或高級人員。南華金融及其管理人員、董事和雇員等(不包括分析員),將不時持長倉或短倉、作為交易當事人,及買進或賣出此研究報告中所述的公司的證券或衍生工具(包括期權和認股權證);及/或為該等公司履行服務或招攬生意及/或對該等證券或期權或其他相關的投資持有重大的利益或影響交易。南華金融可能曾任本報告提及的任何機構所公開發售證券的經理人或聯席經理人,或現正涉及其發行的主要莊家活動,或在過去12個月內,曾向本報告提及的證券發行人提供有關的投資或一種相關的投資或投資銀行服務的重要意見或投資服務。南華金融可能在過去12個月內就投資銀行服務收取補償或受委託及/或可能現正尋求該公司投資銀行委託。
重要說明:此報告和報告中提供的資訊和意見,由南華資料研究有限公司及/或南華金融向其或其各自的客戶提供資訊而準備,並且以合理謹慎的原則編制,所用資料、資訊或資源均于出版時為真實、可靠和準確的。南華資料研究有限公司對本報告或任何其內容的準確性或完整性或其他方面,無論明示或暗示,無作出任何陳述或保證。南華資料研究有限公司及/或南華金融,及其或其各自的董事、管理人員、合夥人、代表或雇員並不承擔由於使用、出版、或分發全部或部分本報告或其任何內容,而產生的任何性質的任何直接或間接損失或損害的任何責任。本報告所載資訊和意見會或有可能在沒有任何通知的情況下而變動或修改。
南華資料研究有限公司及/或南華金融,及其或其各自的董事、管理人員、合夥人、代表或雇員可能在本報告中提到的公司直接或間接擁有股權,或可能不時購買、出售、或交易或向客戶要約購買、出售、或交易此類證券,而該等交易可能是為其帳戶作為交易當事人或代理人或任何其他身份或代表他人。這份報告不是、也不是為了、也不構成任何要約或要約購買或出售或其他方式交易本報告述及的證券。本報告受版權保護及擁有其他權利。據此,未經南華資料研究有限公司明確表示同意,本報告不得用於任何其他目的,也不得出售、分發、出版、或以任何方式轉載。本刊物批准在英國由南華證券(英國)有限公司分派。南華證券(英國)有限公司為一間獲英國金融服務局授權和受該局監管的公司。投資者參閱此報告時,應明白及瞭解其投資目的及相關投資風險,投資前亦應諮詢其獨立的財務顧問。